磯グループ
私たちは、10年来、心臓と全身の脂肪酸代謝・グルコース代謝について研究を重ね、in vivo代謝を多角的に評価することで、多くの原著論文を発表してきました。これまでの研究内容を4つに分けて解説します。
1. FABP4/5を介する経内皮的脂肪酸輸送
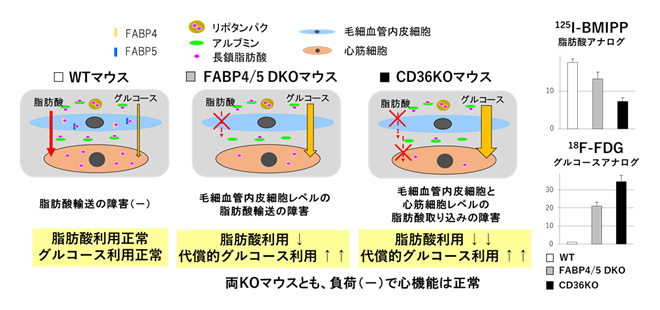
脂肪酸代謝における毛細血管の役割は、これまでほとんど考慮されていませんでした。心臓・骨格筋などにみられる筋型毛細血管内皮細胞は連続型毛細血管に属し、循環血液と実質組織間質を隔て物質交換のインターフェイス(境界面)として機能します。fatty acid binding protein(FABP1-9)は脂肪酸の結合タンパクで、主に細胞内での脂肪酸の貯蔵と輸送に関与すると考えられていました。私たちは、FABP4とFABP5がこれまで発現が知られていた脂肪細胞・マクロファージ以外に、心臓の毛細血管内皮細胞に豊富に発現し、これまで知られていない新たな機能を有することを明らかにしました。FABP4/5 double KO(DKO)マウスの心臓では125I-BMIPP(脂肪酸アナログ)の取り込みは野生型の70%に減少し、相対して18F-FDG(グルコースアナログ)取り込みが野生型の約20倍上昇しました(下図)。つまり、受動的拡散ではない毛細血管内皮細胞のFABP4/5を介する輸送により、遊離脂肪酸は血中から心筋間質へ効率よく運搬されることが明らかになりました(経内皮的脂肪酸輸送、下図)。脂肪酸輸送が障害されるFABP4/5DKOマウスの心臓では、エネルギー不足を補うために代償的にグルコース代謝が著しく亢進することも明らかになりました。この二次的なグルコース代謝亢進はインスリン非依存的であり、アロステリック調整や転写後調整により糖取り込み亢進・解糖系亢進が生じることによることがわかりました。
Iso T, Kurabayashi M, et al. Capillary Endothelial Fatty Acid Binding Proteins 4 and 5 Play a Critical Role in Fatty Acid Uptake in Heart and Skeletal Muscle.
Arterioscler Thromb Vasc Biol. 2013. (corresponding author)
Goto K, Iso T (equal contributor), Kurabayashi M, et al. PPARgamma in Capillary Endothelia Promotes Fatty Acid Uptake by Heart During Long-term Fasting.
J Am Heart Assoc. 2013. (corresponding author)
2. 脂肪酸利用障害時の全身の代謝応答
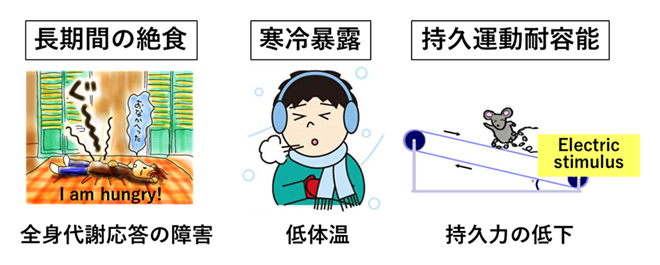
FABP4/5は骨格筋の連続型毛細血管内皮細胞にも高発現します。赤筋の主要なエネルギー基質は脂肪酸であり、FABP4/5 DKOマウスでは、赤筋でも脂肪酸利用が低下しグルコース代謝が亢進します。そこで、脂肪酸利用の依存度が増加する絶食状態でのDKOマウスの代謝応答を観察しました。すると、低血糖・高遊離脂肪酸・著明な脂肪肝・高ケトン体血症が認められました。これらは、長期絶食により、(1)心臓・赤筋で脂肪酸利用が低下するため遊離脂肪酸濃度が上昇すること、(2)代償的にグルコース取り込みが亢進するためインスリン非依存的に血糖が低下すること、(3) 心筋・赤筋で利用されない脂肪酸が肝臓に集積すること、(4)肝臓での脂肪酸酸化は障害されないためケトン体産生が亢進すること、に起因することがわかりました。さらに、絶食後に寒冷環境下(4℃)に暴露すると急速な低体温を呈し、また、絶食後にトレッドミル負荷を行うと著明な持久運動能の低下を呈しました。これらの現象は、熱産生のためのエネルギー源(褐色脂肪組織の中性脂肪と骨格筋のグリコーゲン)や持久運動のためのエネルギー源(肝臓と骨格筋のグリコーゲン)が絶食により急速に枯渇し、血中からのエネルギー基質の補充(グルコース、脂肪酸)も低下するためと考えられた。これら絶食時の低体温と運動耐容能の低下は、CD36KOマウスでも認められました。以上より、心臓・骨格筋で脂肪酸が利用できないと、絶食時のエネルギーホメオスタシスが容易に破綻することが明らかとなりました。つまり、長期の飢餓や低温など、想定されうる厳しい自然環境に対して非耐性になることが明らかとなりました。
Iso T, Haruyama H, Kurabayashi M, et al. Exercise endurance capacity is markedly reduced due to impaired energy homeostasis during prolonged fasting inFABP4/5 deficient mice.
BMC Physiol. 2019. (corresponding author)
Iso T, Haruyama H, Kurabayashi M, et al. CD36 is indispensable for nutrient homeostasis and endurance exercise capacity during prolonged fasting.
Physiol Rep. 2018. (corresponding author)
Putri M, Syamsunarno MRAA, Iso T, Kurabayashi M, et al. CD36 is indispensable for thermogenesis under conditions of fasting and cold stress.
Biochem Biophys Res Commun. 2015. (corresponding author)
Syamsunarno MRAA, Iso T, Kurabayashi M, et al. Fatty acid binding protein 4 and 5 play a crucial role in thermogenesis under the conditions of fasting and cold stress.
PLoS One. 2014. (corresponding author)
Syamsunarno MRAA, Iso T, Kurabayashi M, et al. A critical role of fatty acid binding protein 4 and 5 (FABP4/5) in the systemic response to fasting.
PLoS One. 2013. (corresponding author)
3. 脂肪酸利用障害マウス心臓の病態下の代謝応答
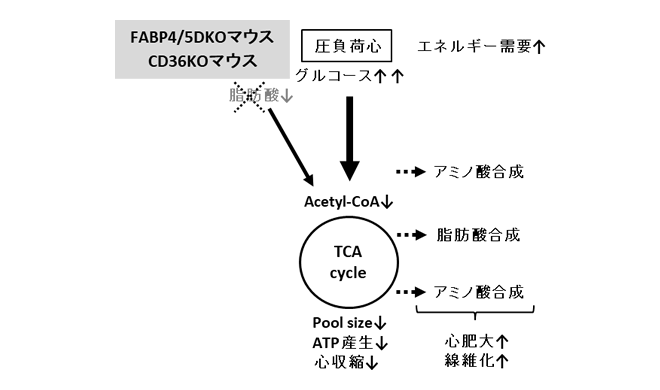
FABP4/5DKOマウスとCD36KO マウスは、心臓の脂肪酸取り込みが野生型(WT)と比べて減少し(DKO:約3割、CD36KO:約5割)、代償的かつインスリン非依存的にグルコース取り込みが著しく亢進します(DKO:約20倍、CD36KO:約35倍)(前述、上図)。負荷のない状況では、両マウスの心機能はWTマウスと同等でしたが、大動脈縮窄(TAC)による心臓圧負荷モデルを作成すると、DKO-TACマウスとCD36KO-TACマウスでは、TAC1週間後より、心機能低下を認めました。複合的なin vivo代謝解析により、TAC負荷によりTCA回路の代謝産物の総和(プールサイズ)やATP産生が著しく低下することがわかりました(下図)。また、KOマウスの心臓に取り込まれたグルコースの代謝産物はTCA回路に入るものの、その一部はde novoアミノ酸合成や脂肪酸合成など心肥大反応に利用されることが明らかとなりました(下図)。以上より、エネルギー需要が増大する圧負荷ストレス下では、脂肪酸取り込み低下に伴う代償的グルコース取り込み亢進だけではエネルギー不足が解消されず、総エネルギーの供給不足が顕在化し、心機能低下を呈することが明らかとなりました(下図)。リポポリサッカライド投与による敗血症モデルの心臓では、脂肪酸代謝のみならず、グルコース代謝も著しく障害されることがわかりました。
Umbarawan Y, Syamsunarno MRAA, Kurabayashi M, Iso T, et al. Myocardial fatty acid uptake through CD36 is indispensable for sufficient bioenergetic metabolism to prevent progression of pressure overload-induced heart failure.
Sci Rep. 2018. (corresponding author)
Umbarawan Y, Mas Rizky AA, Kurabayashi M, Iso T, et al. Glucose is preferentially utilized for biomass synthesis in pressure-overloaded hearts: Evidence from fatty acid binding protein-4 and -5 knockout mice.
Cardiovasc Res. 2018. (corresponding author)
Umbarawan Y, Syamsunarno MRAA, Kurabayashi M, Iso T, et al. Robust suppression of cardiac energy catabolism with marked accumulation of energy substrates during lipopolysaccharide-induced cardiac dysfunction in mice.
Metabolism. 2017. (corresponding author)
4. 血中FABP4上昇の病態生理的意義
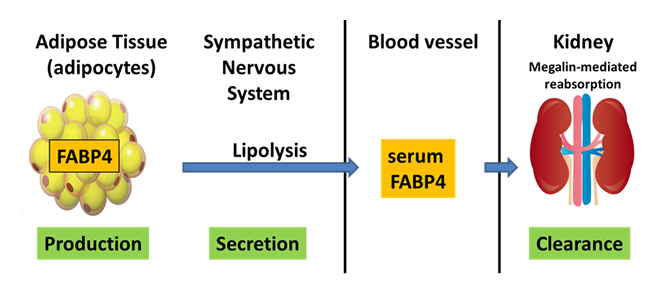
FABP4は脂肪細胞に豊富に発現し、血中に放出されることが知られています。血中FABP4の上昇は、肥満・2型糖尿病・高血圧・脂肪肝・動脈硬化・慢性腎臓病と関連することが報告されていました。私たちは、血中FABP4が、急性心筋梗塞の急性期に最も高値となり、院外心停止の症例で、著しく高値を示すことを報告しました。健常者ボランティアの心肺運動負荷試験では、BMIが大きいほど、運動負荷の強度が大きいほど、血中ノルエピネフリン濃度の上昇率が大きいほど、血中FABP4の上昇が認められました。以上より、脂肪細胞の蓄積(肥満)と交感神経の活性化が血中FABP4上昇の大きな要因となることが推測されました。私たちは、マウスモデルを用いで腎機能と血中FABP4との関連も調べました。血中FABP4は、糸球体を通過し腎臓近位尿細管上皮細胞の刷子縁に発現するメガリンを介して再吸収されクリアランスされることを明らかにしました。また、腎機能障害が進行すると腎臓のFABP4クリアランスが低下し、血中FABP4濃度が上昇することを示しました。以上より、血中FABP4濃度は、(1)脂肪細胞の蓄積量、(2)交感神経の活性化、(3)腎臓のFABP4クリアランスにより制御されることが明らかになりました。
Obokata M, Iso T (equal contributor), Kurabayashi M et al. Early increase in serum fatty acid binding protein 4 levels in patients with acute myocardial infarction.
Eur Heart J Acute Cardiovas Care. 2018.
Iso T, Kurabayashi M, et al. Serum levels of fatty acid binding protein 4 and fat metabolic markers in relation to catecholamines following exercise.
Clin Biochem. 2017. (corresponding author)
Shrestha S, Kurabayashi M, Iso T, et al. Circulating FABP4 is eliminated by the kidney via glomerular filtration followed by megalin-mediated reabsorption.
Sci Rep. 2018. (corresponding author)
| [上記内容(1, 2, 3)に関する総説と著書] |
| (総説) 月刊 細胞 2014; 46 (7); 303-306, 内分泌・糖尿病・代謝内科 2014; 39 (6); 449-454, Annual Review 糖尿病・代謝・内分泌 2015; 98-104, 循環器内科 2017; 81(5); 476-482, 循環器内科 2019; 85(3); 312-319, 心臓 2020; 52 (2); 201-209. (著書) Iso T, Kurabayashi M. Fatty Acid Uptake by the Heart During Fasting. (Chapter 8) Effects of undernutrition: general aspects, organs and tissue systems. Handbook of Famine, Starvation, and Nutrient Deprivation (edited by Preedy and Patel). 2017: 1-20. Springer International Publishing. Chapter DOI: 10.1007/978-3-319-40007-5_13-1. |
- 基礎研究部門について
- 基礎研究グループ





