小板橋グループ
心肥大と心不全
人間の心臓は250-300gの筋肉でできた袋ですが、70年生きたとして30億回収縮し、2億Lの血液を拍出しています。私たちが持っている筋肉のなかで最も酷使されている筋肉です。非常に頑丈な臓器であるべき心臓ですが、血圧が高かったり、心筋梗塞を起こしたり、遺伝子が少し異常を来したりすると、心臓肥大から収縮不全を起こし、ポンプ失調=心不全に陥ります。心臓は外的ストレスに対して、代償的に肥大を起こし、その機能を補おうとしますが、長期間ストレスにさらされると、その代償機転が破たんしたり、代償機転そのものが心臓にとって増悪因子として働いたりします。
このメカニズムに関しては、この30年間で数多くの研究がなされて、多くのことが分かってきました。しかし心不全で亡くなる人は多く、また心移植を待っている重症の心不全の人は世界中にたくさんいます。しかし心不全の薬物治療はACE阻害薬とβ遮断薬があるだけでそこから大きな進歩がないと言っても過言ではありませんでした。そんな中、SGLT2阻害薬やARNIといった新たな可能性をもつ治療薬が出現し、心不全治療が変わりつつあります。
わたくし小板橋は群馬大学で研究の基礎を学んだあと、アメリカのJohns Hopkins大学、David A. Kass教授の下で、心臓生理学とマウスの病態モデルを学び、2011年に帰国。分子と生理学とをつなげるような研究スタイルを確立しました。
小板橋グループは、この心肥大、心不全の分子メカニズムを明らかにし、新たな治療法を確立することを、最終目標にしています。メカニズムを解明する方法として、遺伝子改変マウスを用い、さらにそこに圧負荷、心筋梗塞、慢性腎不全などの病的なストレスをかけることにより、ヒトの病態に近いモデルを作り、詳細に解析を行います。
ごく最近、共同研究者と細胞のエネルギー源であるATPを可視化できるマウスを開発。うごいている心臓でのエネルギー代謝をモニターする技術を開発しました(未発表)。世界トップクラスの技術を用いて、未来の心臓病治療開発に向けた研究を進めていきます。
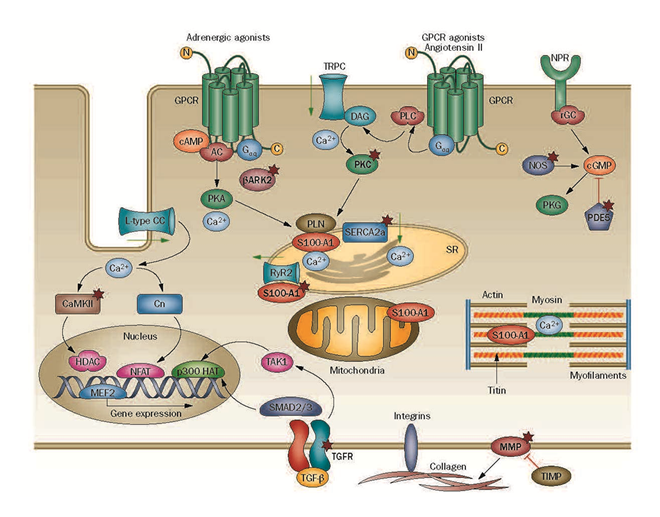
心肥大、心不全のときに心筋細胞内で起きている細胞内シグナリングの活性化。未来の治療ターゲットです。
(Koitabashi & Kass, Nature Review Cardiologyより)
メンバー
小板橋紀通 (講師)
研究テーマ
1) 心臓のストレス応答~細胞特異的応答が心臓全体に与える影響~
2) 拍動する心臓におけるATPの可視化
3) 肺高血圧症とTGFβシグナリング
4) メタボリックサイトカイン、FGF21の心肥大・心不全における役割
5) タイチンのリン酸化と心臓拡張障害
など。
実験手技
マウスモデル
1) 大動脈縮窄モデル TAC
2) 心筋梗塞モデル
3) 腎不全モデル
4) 肺高血圧症モデル
心エコー
心臓カテーテル (コンダクタンスカテーテル法)
血圧測定
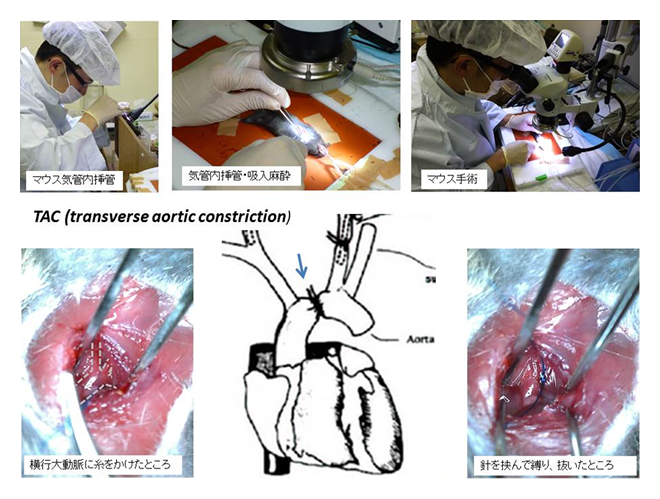
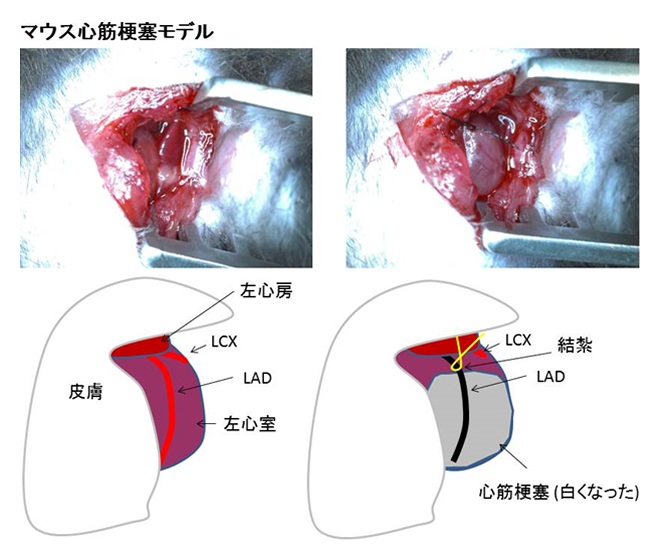

細胞培養
1) Neonatal rat cardiac myocytes
2) Neonatal rat cardiac fibroblasts
3) Adult rat cardiac myocytes
4) Adult rat cardiac fibroblasts
5) Adult mouse cardiac myocytes
6) Adult mouse cardiac fibroblasts
論文
- Koitabashi N, Kass DA.
Reverse remodeling in heart failure-mechanisms and therapeutic opportunities. Nat Rev Cardiol. 2012; 9: 147-157. - Koitabashi N, Danner T, Zaiman AL, Pinto YM, Rowell J, Mankowski J, Zhang D, Nakamura T, Takimoto E, Kass DA.
Pivotal role of cardiomyocyte TGF-b signaling in the murine pathological response to sustained pressure overload. J Clin Invest 2011; 121: 2301-12 - Watanabe A, Arai M, Koitabashi N, Niwano K, Ohyama Y, Yamada Y, Kato N, Kurabayashi M.
Mitochondrial Transcription Factors, TFAM and TFB2M, Regulate Serca2 Gene Transcription. Cardiovasc Res. 2011; 90: 57-67. - Koitabashi N, Aiba T, Hesketh GG, Rowell J, Zhang M, Takimoto E, Tomaselli, GF, Kass DA
Cyclic GMP/PKG-dependent Inhibition of TRPC6 channel activity and expression negatively regulates cardiomyocyte NFAT activation, Novel mechanisms of cardiac stress modulation by PDE5 inhibition. J Mol Cell Cardiol. 2010; 48: 713-24 - Koitabashi N, Bedja D, Zaiman AL, Pinto YM, Zhang M, Gabrielson KL, Takimoto E, Kass DA
Avoidance of transient cardiomyopathy in cardiomyocyte-targeted tamoxifen-induced MerCreMer gene deletion models. Circ Res. 2009: 105: 12-5 - Niwano K, Arai M, Koitabashi N, Watanabe A, Ikeda Y, Miyoshi H, Kurabayashi M
Lentiviral vector-mediated SERCA2 gene transfer protects against heart failure and left ventricular remodeling after myocardial infarction in rats. Mol Ther 2008; 16: 1026-32 - Koitabashi N, Arai M, Kogure S, Niwano K, Watanabe A, Aoki Y, Maeno T, Nishida T, Kubota S, Takigawa M, Kurabayashi M
Increased connective tissue growth factor relative to brain natriuretic peptide as a determinant of myocardial fibrosis. Hypertension. 2007; 49: 1120-7
学会発表
- American Heart Association, Scientific Sessions 2016, 2016.11.12-16(New Orleans)
Furukawa N,Koitabashi N,Sunaga H,Obokata M,Yogi Umbarawan、Yamaguchi A,Mass Rizky AA Syamsunaruno,Matsui H,Yokoyama T,Kurabayashi M.
Vildagliptin Attenuates Cardiac Hypertrophy and Improves Ventricular Efficiency through FGF21 Expression in Pressure-oberloaded Mouse Heart - 第80回日本循環器学会学術集会 2016.3.18~20(仙台)
Koitabashi N,Seki M、Furukawa N、Sunaga H、Yokoyama T、Kurabayashi M
The Role of Periostin Expressing Cells in Pathogenesis of Pulmonary Arterial Hypertension - 他多数
- 基礎研究部門について
- 基礎研究グループ





